破译代谢重编程和表观遗传调控之间的串扰是一种很有前途的癌症治疗策略。
2023年5月11日,重庆医科大学唐霓、汪凯和黄爱龙团队在Journal of Clinical Investigation(IF=19)在线发表了题为“Gluconeogenic enzyme PCK1 supports S-adenosylmethionine biosynthesis and promotes H3K9me3 modification to suppress hepatocellular carcinoma progression”的研究论文,该研究发现糖异生酶PCK1通过丝氨酸合成途径促进S-腺苷甲硫氨酸(SAM)的生成。甲基转移酶SUV39H1催化SAM作为甲基供体支持H3K9me3修饰,从而抑制癌基因S100A11。
机制上,PCK1缺陷诱导S100A11的致癌激活是由于其与AKT1相互作用,上调PI3K/AKT信号。有趣的是,在体内和体外,补充SAM或敲除S100A11可抑制PCK1缺乏导致的肝细胞癌(HCC)的进展。总之,该研究揭示了关键代谢物SAM作为连接糖异生酶PCK1和H3K9三甲基化的桥梁在减缓HCC进展中的有效性,从而提示了针对HCC的潜在治疗策略。

表观遗传学的改变和基因表达模式的异常是癌症的主要特征。组蛋白的翻译后修饰失调(PTMs),如甲基化和乙酰化,被认为在许多癌症的发生和发展中起着重要作用。组蛋白甲基化是由组蛋白甲基转移酶(HMT)催化的,它可以激活或抑制基因表达,这取决于被修饰的特定组蛋白残基以及添加的甲基数量。研究最广泛的组蛋白甲基化位点,包括H3K4、H3K36和H3K79,通常与转录激活有关,而H3K9me2、H3K9me3和H3K27me3作为抑制标记。HMT使用S-腺苷蛋氨酸(SAM)作为甲基供体,将其甲基转移生成S-腺苷同型半胱氨酸(SAH)和甲基化底物。
SAM是通过蛋氨酸腺苷转移酶从蛋氨酸循环中产生的。细胞SAM浓度与酶Km值(甲基转移酶反应半最大速度(½Vmax)时的SAM浓度)相称,甲基化状态的变化是由于HMT酶活性的差异而发生的。因此,组蛋白甲基化状态可能受到SAM或SAM合成调节因子波动的影响,这意味着可以将代谢与表观遗传调节联系起来。最近的研究表明,肝脏可以被认为是人体的SAM工厂,近85%的甲基化反应发生在肝脏,这表明异常的SAM水平或异常的组蛋白甲基化可能在癌症的发生中起重要作用。
糖异生是糖酵解的逆向途径,主要发生在肝脏,在代谢重编程和肿瘤生长中起关键作用。胞质异构体PCK1(也称为PEPCK-C或PEPCK1)是肝脏糖异生的初始酶,催化草酰乙酸(OAA)转化为磷酸烯醇丙酮酸(PEP)。既往研究发现,PCK1在肝细胞癌(HCC)中下调,敲除PCK1可增强肝癌在体内和体外的增殖和转移。然而,PCK1在HCC中的复杂代谢功能和机制尚未明确,PCK1是否在组蛋白甲基化中发挥代谢作用以控制基因表达仍不清楚。
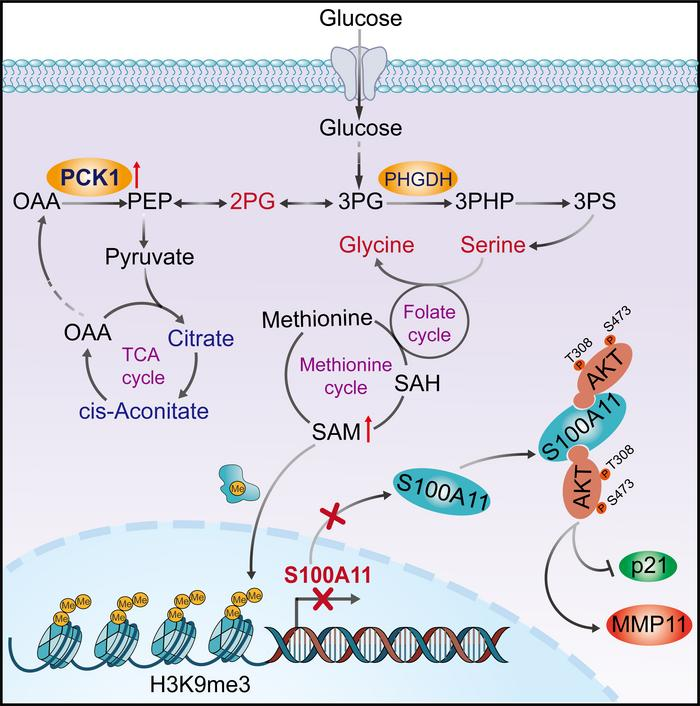
该研究检测了各种组蛋白甲基化标记的相对水平,发现在PCK1缺失的HCC细胞和肝细胞特异性Pck1敲除(LKO)小鼠的肝组织中,组蛋白H3赖氨酸9三甲基化(H3K9me3)显著降低。此外,代谢组学数据显示,丝氨酸合成途径(SSP)在PCK1过表达(PCK1-OE)的肝癌细胞中显著上调。丝氨酸促进单碳代谢,它包括一个相互关联的代谢途径网络,促进单碳单元在SAM生物合成中的利用。
该研究数据表明,PCK1依赖于TCA中间体向SSP的转移,从而调节SAM的可用性,以支持癌基因S100A11启动子上的抑制标记H3K9me3,从而减弱S100A11的表达。该研究结果表明,PCK1控制SAM的可用性,并允许代谢信号和表观遗传状态之间的直接通信,可治疗HCC的临床治疗靶点。
