由新型冠状病毒(SARS-CoV-2)引起的新冠肺炎(COVID-19)疫情对全球公共卫生安全造成严重威胁,世界卫生组织(WHO)已将其列为全球性大流行病,迫切需要有效的治疗策略。严重的新冠肺炎患者通常会经历细胞因子释放综合征(CRS),也称为“细胞因子风暴”,其表现为促炎细胞因子过量分泌,是引起广泛组织损害,多器官功能衰竭等临床危重症的重要因素[1]。
近年来研究发现,细胞代谢重编程在激活免疫系统和炎症反应中起着关键的调控作用。例如,大部分天然免疫细胞的活化具有葡萄糖摄取和糖酵解增加的供能特征,糖代谢的重要中间产物伊康酸可以诱导I型干扰素产生而发挥抗炎作用[2]。虽然已有研究表明COVID-19患者的外周血代谢物与炎症细胞因子的产生密切相关[3],然而对于SARS-CoV-2感染后宿主代谢与免疫应答的潜在调控机制,相关研究报道较少。
2021年3月12日,我校感染性疾病分子生物学教育部重点实验室黄爱龙课题组与清华大学药学院胡泽平课题组合作在Nature Communications期刊上发表题为“Integrated cytokine and metabolite analysis reveals immunometabolic reprogramming in COVID-19 patients with therapeutic implications”的研究论文[4],通过代谢组学和炎症因子整合分析,发现新冠肺炎患者外周血代谢物与细胞因子/趋化因子密切相关,重症新冠肺炎感染患者代谢紊乱与炎症反应过度激活相关。干预精氨酸、色氨酸或嘌呤代谢可以有效抑制SARS-CoV-2感染恒河猴外周血单核细胞的炎症因子释放。

为了探讨COVID-19患者的代谢紊乱与CRS的关联性,研究人员收集了17例健康人血清,入院1-18天的14例轻症感染者血清和23例重症感染者血清,以及7例连续随访轻症感染者血清。采用靶标代谢与非靶标代谢组分析发现与20例非SARS-CoV-2感染的急性上呼吸道感染者比较,COVID-19患者者具有独特的代谢紊乱特征,其中36种代谢物的变化与新冠肺炎严重程度相关,尤为重要的是,与疾病严重程度密切相关的代谢物大多与嘌呤代谢、色氨酸代谢和精氨酸代谢相关。进一步检测COVID-19患者和健康对照者的28种细胞因子和趋化因子,发现CRS相关细胞因子水平随疾病严重程度呈递进式增加。细胞因子与代谢物相关性分析表明,重症患者代谢通路失调与重要的炎性细胞因子密切相关,例如精氨酸与CRS相关炎症因子IL-6、IL-1β、M-CSF、IL-12 p70、IFN-α2等关联性较强。
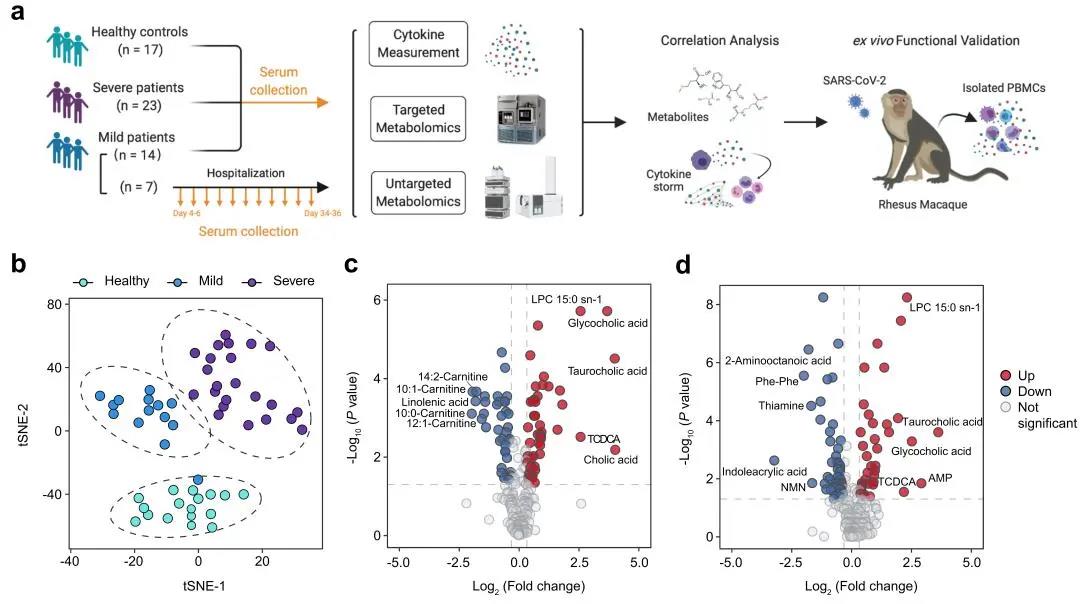
为了进一步验证细胞因子与代谢产物的相关性,研究人员分离出感染SARS-CoV-2的恒河猴PBMC细胞,通过干预相关代谢通路,观察能否调控细胞因子的分泌。研究发现,补充代谢物精氨酸或加入色氨酸代谢抑制剂Epacadostat及嘌呤代谢相关抑制剂霉酚酸可以显著抑制SARS-CoV-2诱导的PBMC细胞促炎因子释放,其中大部分与CRS有关。提示血清精氨酸代谢可能在SARS-CoV-2诱导的过度炎症反应中发挥改善作用,可作为COVID-19 CRS的潜在治疗策略。相反,PBMC细胞中加入混合促炎细胞因子后部分代谢物增加,表明代谢重编程可能部分是由SARS-CoV-2感染诱导的炎症细胞因子引起。该研究为SARS-CoV-2感染引起CRS的分子机制提供了新的见解,提示代谢干预可能是一种抑制SARS-CoV-2诱导CRS的新策略。
清华大学药学院博士后肖楠、博士后聂萌、博士生庞欢欢、博士后王博弘和重庆医科大学感染性疾病分子生物学教育部重点实验室胡接力研究员为该论文的共同第一作者。清华大学药学院胡泽平教授、重庆医科大学感染性疾病分子生物学教育部重点实验室黄爱龙教授与唐霓教授为共同通讯作者。研究工作得到了重庆市科学技术局和重庆医科大学新型冠状病毒性肺炎应急项目、国家传染病科技重大专项等项目支持。
原文链接:
https://doi.org/10.1038/s41467-021-21907-9
参考文献
1. Mangalmurti N, Hunter CA. Cytokine Storms: Understanding COVID-19. Immunity. 2020 Jul 14; 53(1):19-25.
2. Lampropoulou V, Sergushichev A, Bambouskova M, et al. Itaconate Links Inhibition of Succinate Dehydrogenase with Macrophage Metabolic Remodeling and Regulation of Inflammation. Cell Metab. 2016 Jul 12; 24(1):158-66.
3. Su Y, Chen D, Yuan D, et al. Multi-Omics Resolves a Sharp Disease-State Shift between Mild and Moderate COVID-19. Cell. 2020 Dec 10; 183(6):1479-1495.e20.
4. Xiao N, Nie M, Pang H. et al. Integrated cytokine and metabolite analysis reveals immunometabolic reprogramming in COVID-19 patients with therapeutic implications. Nat Commun 12, 1618 (2021). https://doi.org/10.1038/s41467-021-21907-9
